Презентация - "Презентация по химии по итогам 8 класса"
- Презентации / Другие презентации
- 1
- 30.04.24
Просмотреть и скачать презентацию на тему "Презентация по химии по итогам 8 класса"
Сайт klass-uchebnik.com предлагает качественные учебные материалы для школьников, родителей и учителей. Здесь можно бесплатно читать и скачивать современные учебники, рабочие тетради, а также наглядные презентации по всем предметам школьной программы. Материалы распределены по классам и темам, что делает поиск максимально удобным. Каждое пособие отличается логичной структурой, доступной подачей материала и соответствует действующим образовательным стандартам. Благодаря простому языку, наглядным схемам и практическим заданиям, обучение становится легче и эффективнее. Учебники подойдут как для ежедневной подготовки к урокам, так и для систематического повторения перед экзаменами.
Особое внимание стоит уделить разделу с презентациями - они становятся отличным визуальным дополнением к теории, помогают лучше понять сложные темы и удерживают внимание учащихся. Такие материалы удобно использовать в классе на интерактивной доске или при самостоятельной подготовке дома. Все размещённые на платформе материалы проверены на актуальность и соответствие учебной программе. Это делает сайт надёжным помощником в образовательном процессе для всех участников: школьников, учителей и родителей. Особенно удобно, что всё доступно онлайн без регистрации и в свободном доступе.
Если вы ищете надежный источник для подготовки к урокам, контрольным и экзаменам - klass-uchebnik.com станет отличным выбором. Здесь вы найдёте всё необходимое, включая "Презентация по химии по итогам 8 класса", чтобы сделать обучение более организованным, интересным и результативным.
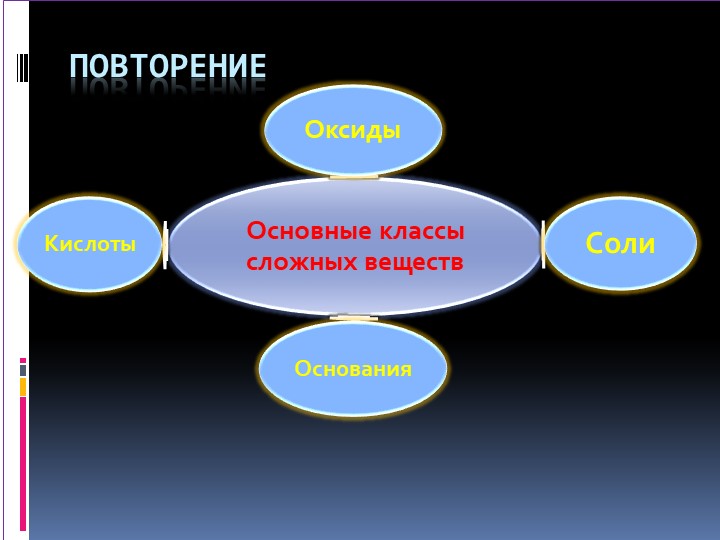
Оксиды
Оксиды –это сложные вещества, состоящие из двух химических элементов, один из которых- кислород со степенью окисления -2.
Fe2O3
H2O
SiO2
Cl2O7
P2O5
SO2
Оксиды
Основные
Оксиды металлов (с.о. +1,+2)
CaO, CrO, MnO, Li2O
Кислотные
Оксиды неметаллов
Оксиды металлов (с.о. +5,+6,+7)
СO2, SO3, P2O5, N2O3,CrO3, Mn2O7
Амфотерные
Оксиды металлов (с.о.+2,+3,+4)
Fe2O3, Al2O3,ZnO, BeO
Степень окисления простых веществ равна нулю
Например: S0, H02, Cl02, O02, Na0.
Максимальная (высшая) степень окисления равна + номер группы (элемент на первом месте)
Например: P2+5O5 , S+6F6.
Если степень окисления переменная – будет указано в скобках.
Минимальная степень окисления равна – ( 8 – номер группы) (элемент на втором месте)
Например: SCl2-1 , Li3P-3.
Постоянные степени окисления:
H +1 (кроме гидридов активных металлов, например:Na+1H-1)
O-2 (кроме O+2F2, H2O2-1,пероксидов металлов)
F-1
металлы первой группы (кроме Cu, Au) –степень окисления
металлы второй группы (кроме Hg) – степень окисления
B и металлы третьей группы – степень окисления
Определение степени окисления
+2
+1
+3
Окислитель-это вещество, в состав которого входит элемент, принимающий электроны
Cu2+ + 2e- =Cu0
А процесс который при этом происходит называется процессом восстановления
Степень окисления атома при этом понижается










